В зависимост от разтворителя се разграничават водни и неводни разтвори. Неводните разтвори са разтвори на вещества в органични разтворители.
Според точността на изразяване на концентрацията разтворите се делят на разтвори с приблизителна и точна концентрация.
Масова фракция - съотношението на масата на даден компонент на системата към общата маса на тази система:
Често масовата част се изразява в части от единица, процент (%), ppm (хилядна от a%) и в части на милион (ppm).
Моларна фракция - съотношението на количеството вещество (в mol) на компонент, съдържащ се в дадена система, към общото количество вещество в системата (в mol):
![]()
Моларна концентрация - съотношението на количеството вещество l (X), съдържащо се в системата (например в разтвор) към обема на системата V(х) и има размерността mol / m 3 (в SI) или по-често mol / l:
![]()
Моларността на разтвора се записва като числената стойност на моларната концентрация на разтвореното вещество в mol/l, последвана от буквата M или думата "molar".
Например 1 М или едномоларен разтвор, 0,1 М или децимоларен разтвор, 0,01 М или сентомоларен разтвор, 0,001 М или милимоларен разтвор.
Друг пример. Масата на мол сярна киселина е 98,08 g, което означава, че един литър от 1 M разтвор на сярна киселина съдържа 98,08 g H 2 S0 4, а един литър от 0,1 M разтвор съдържа 9,808 g H 2 S0 4 , съответно.
Моларната концентрация на еквивалента е отношението на броя на моловите еквиваленти в системата към обема на тази система:
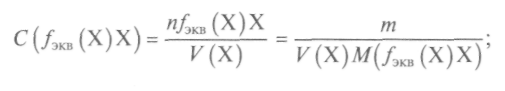
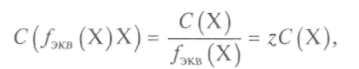
където е броят на моловите еквиваленти; ![]() - кътник
- кътник
масата на еквивалента на веществото; - масата на един мол еквивалент на това вещество, равна на произведението на фактора на еквивалентност от моларната маса на веществото
Коефициентът на еквивалентност обозначава съотношението на реалната част
частица от вещество, еквивалентна на един водороден йон в дадена киселинно-алкална реакция или на един електрон в дадена редокс реакция.
ленти от материя могат да бъдат наречени нор-
малък разтвор на това вещество и се обозначава със символа "n." посочване ![]() в скоби на коефициента на еквивалентност, например,
в скоби на коефициента на еквивалентност, например,
Моларната маса на еквивалента на вещество X е равна на произведението на фактора на еквивалентност по моларната маса на веществото M(X):
И има измерението на моларната маса.
Моларната концентрация е съотношението на количеството дис-
създадено вещество X (в молове) към маса Tразтворител Y (в килограми):
Терминът молалност е за предпочитане да се използва в случай на реакции, протичащи при неизотермични условия.
Масова концентрация p(X) - съотношението на масата на компонента, съдържащ се в системата (разтвор) към обема на тази система (разтвор).
За решения: 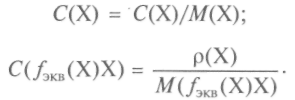
Плътността на разтвора е съотношението на масата на разтвора към неговия обем:
Връзката между плътността на разтвора, масовата част и моларната концентрация се изразява с уравненията:
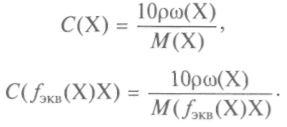
Титърът на разтвора е масата на веществото, съдържащо се в 1 cm 3
или 1 ml разтвор.
Ключови думи : разтвори, разтворено вещество, разтворител, разтворимост, наситени и ненаситени разтвори, масова част на разтвореното вещество, моларност, нормалност, молалност, молна фракция, титър, осмотично налягане, намаляване на налягането на парите над разтвор, ебулиоскопична константа, криоскопична константа.
Решениее твърда, течна или газообразна хомогенна система, състояща се от два или повече компонента ( съставни части), чиито относителни количества могат да варират в широк диапазон. Всяко решение се състои от разтворени веществаи разтворителсреда, в която тези вещества са равномерно разпределени под формата на молекули или йони.
Разтвор, в който дадено вещество при дадена температура вече не се разтваря, т.е. разтвор в равновесие с разтворено вещество се нарича богати разтвор, в който все още може да се разтвори допълнително количество от дадено вещество, ненаситени.
Концентрацията на разтворите може да се изрази по следните начини:
1. Процентна концентрация по маса (ω, %) - броят на единиците маса (например броят на грамовете) на разтвореното вещество (m r.v.), съдържащи се в 100 единици маса (например в 100 грама) от разтвора (m разтвор):
ω= (m r.v. 100%)/m разтвор.Например, 15% разтвор на натриев хлорид е такъв разтвор, 100 g от който съдържа 15 g NaCl и 85 g вода.
2. Моларност(См) - брой молове (n) разтворено вещество, съдържащо се в 1 литър разтвор: C m = n/V. И така, 2MH 2 SO 4 означава разтвор на сярна киселина, всеки литър от който съдържа два мола H 2 SO 4, 196 g.
3. Моларна еквивалентна концентрация (нормалност)(C H): - броя на моловите еквиваленти (n eq) на разтвореното вещество, съдържащо се в един литър разтвор: Така че, 2n. H 2 SO 4 означава разтвор на сярна киселина, всеки литър от който съдържа два еквивалента, т.е. 98 g H 2 SO 4.
4. молалност(с m) - броя на моловете разтворено вещество на 1000 g разтворител. И така, 2m H 2 SO 4 означава разтвор на сярна киселина, в който има два мола H 2 SO 4 на 1000 g вода. Концентрацията на моларната маса на разтвора - молалността, за разлика от неговата моларност, не се променя с температурата.
5. Молна фракция(Ni) - съотношението на броя молове на дадено вещество (n 1) към общия брой молове на всички вещества (n 1, n 2), присъстващи в разтвора: N 1 \u003d n 1 / (n 1 + n 2).
Използвайки разтвори, чиято концентрация е изразена чрез нормалност, е лесно да се изчисли предварително в какви обемни съотношения трябва да се смесят, така че разтворените вещества да реагират без остатък:
C H 1 V 1 \u003d C H2 V 2, където C H1, C H2 са моларните концентрации на еквивалента (mol) на разтвореното вещество 1 и съответно 2; V 1 , V 2 - обеми на разтвори (l) 1 и 2, съответно. По този начин обемите на разтворите на реагиращите вещества са обратно пропорционални на техните нормалности.
Свойства на разтворите. Относителен спад на наляганетонаситената пара на разтворителя върху разтвора е равна на молната част на разтвореното вещество (закон на Раулт, 1887): N 2 \u003d [(P o - P) / P o], където N 2 - молна фракция на разтворено вещество; P0 - налягане на наситените пари на разтворителя спрямо чистия разтворител (kPa), P - налягане на наситените пари на разтворителя върху разтвора (kPa).
Нарича се еднопосочна дифузия на разтворител в разтвор през полупропусклива преграда осмоза.Обемът на разтвора се увеличава в резултат на осмозата, докато върху стените на съда, в който се намира разтворът, възниква натиск. Това налягане се нарича осмотичен(P osm, kPa) : P osm = i C m R T, където C m е моларната концентрация, R е универсалната газова константа, T е температурата, K
Изотонично съотношение аз(коефициент на Вант Хоф) -корекционен фактор, отразяващ увеличението на броя на частиците в електролитни разтвори в сравнение с неелектролитни разтвори със същата концентрация.
Криоскопия- физикохимичен метод за изследване на течни разтвори на нелетливи вещества, базиран на измерване на намаляването на точката на замръзване на разтвор в сравнение с точката на замръзване на чист разтворител. Понижаване на температурата (Δt zam) разтвор за замразяване:
Δt заместник = i K C m, където K е криоскопичната константа на разтворителя - големината на понижението на точката на замръзване на разтвора, който съдържа 1 mol разтворено вещество в 1 kg разтворител, См- моларна концентрация на разтвора.
Ебулиоскопия- метод за изследване на течни разтвори на нелетливи вещества, базиран на измерване на повишаването на точката на кипене на разтвор в сравнение с точката на кипене на чист разтворител. Покачване на точката на кипене (Δtbp) на разтвора:Δt бала = i E C m, където E е ебулиоскопската константа (константа) на разтворителя - големината на повишаването на точката на кипене на разтвор, който съдържа 1 мол разтворено вещество на 1 kg разтворител. Изотоничен коефициент ( аз) е свързано със степента на дисоциация ( α ) електролитно съотношение α =[(i - 1) / (k - 1)] , където k - броят на йоните, на които се разлага електролитната молекула при дисоциация (за KCl k=2,за BaC1 2 и Na 2 SO 4 k = 3 и т.н.).
1. От какви компоненти се състои разтворът?
2. Какви разтвори се наричат наситени?
3. Избройте основните начини за изразяване на концентрацията на разтворите.
4. Какво означават записите: 2,5 M NaOH, 0,1 n H 2 SO 4?
1. Глинка Н.Л. Обща химия: учебник. надбавка за университети / N.L. Глинка. - М.: КНОРУС, 2009. - С. 217 - 236.
2. Коровин Н.В. Обща химия: учебник за технически направления. и специални университети - 7 изд., попр. - М.: висше училище, 2006. - С. 204.
Е.А. Буйлова, Д.Р. Галиева
Ключови думи: разтвори, разтворено вещество, разтворител, разтворимост, наситени и ненаситени разтвори, масова част на разтвореното вещество, моларност, нормалност, молалност, молна фракция, титър, осмотично налягане, намаляване на налягането на парите над разтвор, ебулиоскопична константа, криоскопична константа.
Решениее твърда, течна или газообразна хомогенна система, състояща се от два или повече компонента (компоненти), чиито относителни количества могат да варират в широк диапазон. Всяко решение се състои от разтворени веществаи разтворителсреда, в която тези вещества са равномерно разпределени под формата на молекули или йони.
Разтвор, в който дадено вещество при дадена температура вече не се разтваря, т.е. разтвор в равновесие с разтворено вещество се нарича богати разтвор, в който все още може да се разтвори допълнително количество от дадено вещество, ненаситени.
Концентрацията на разтворите може да се изрази по следните начини:
1. Процентна концентрация по маса (ω, %) - броят на единиците маса (например броят на грамовете) на разтвореното вещество (m r.v.), съдържащи се в 100 единици маса (например в 100 грама) от разтвора (m разтвор):
ω= (m r.v. 100%)/m разтвор. Например 15% разтвор на натриев хлорид е такъв разтвор, 100 g от който съдържа 15 g NaCl и 85 g вода.
2. Моларност(См) - номер мол (n) разтворено вещество, съдържащо се в 1 литър разтвор: C m = n/V. Да, 2M H 2 SO 4 означава разтвор на сярна киселина, всеки литър от който съдържа два мола H 2 SO 4, 196 g.
3. Моларна еквивалентна концентрация (нормалност)(C H): - броя на моловите еквиваленти (n eq) на разтвореното вещество, съдържащо се в един литър разтвор: Така че, 2n. H 2 SO 4 означава разтвор на сярна киселина, всеки литър от който съдържа два еквивалента, т.е. 98 g H 2 SO 4.
4. молалност(с m) - броя на моловете разтворено вещество на 1000 g разтворител. И така, 2m H 2 SO 4 означава разтвор на сярна киселина, в който има два мола H 2 SO 4 на 1000 g вода. Концентрацията на моларната маса на разтвора - молалността, за разлика от неговата моларност, не се променя с температурата.
5. Молна фракция(Ni) - съотношението на броя молове на дадено вещество (n 1) към общия брой молове на всички вещества (n 1, n 2), присъстващи в разтвора: N 1 \u003d n 1 / (n 1 + n 2).
Използвайки разтвори, чиято концентрация е изразена чрез нормалност, е лесно да се изчисли предварително в какви обемни съотношения трябва да се смесят, така че разтворените вещества да реагират без остатък:
C H 1 V 1 \u003d C H2 V 2, където C H1, C H2 са моларните концентрации на еквивалента (mol) на разтвореното вещество 1 и съответно 2; V 1 , V 2 - обеми на разтвори (l) 1 и 2, съответно. По този начин обемите на разтворите на реагиращите вещества са обратно пропорционални на техните нормалности.
Свойства на разтворите. Относителен спад на наляганетонаситената пара на разтворителя върху разтвора е равна на молната част на разтвореното вещество (закон на Раулт, 1887): N 2 \u003d [(P o - P) / P o], където N 2 - молна фракция на разтворено вещество; P0 - налягане на наситените пари на разтворителя спрямо чистия разтворител (kPa), P - налягане на наситените пари на разтворителя върху разтвора (kPa).
Нарича се еднопосочна дифузия на разтворител в разтвор през полупропусклива преграда осмоза.Обемът на разтвора се увеличава в резултат на осмозата, докато върху стените на съда, в който се намира разтворът, възниква натиск. Това налягане се нарича осмотичен(P osm, kPa) : P osm = i C m R T, където C m е моларната концентрация, R е универсалната газова константа, T е температурата, K
Изотонично съотношение аз(коефициент на Вант Хоф) -корекционен фактор, отразяващ увеличението на броя на частиците в електролитни разтвори в сравнение с неелектролитни разтвори със същата концентрация.
Криоскопия- физикохимичен метод за изследване на течни разтвори на нелетливи вещества, базиран на измерване на намаляването на точката на замръзване на разтвор в сравнение с точката на замръзване на чист разтворител. Понижаване на температурата (Δt zam) разтвор за замразяване:
Δt заместник = i K C m, където K е криоскопичната константа на разтворителя - големината на понижението на точката на замръзване на разтвора, който съдържа 1 mol разтворено вещество в 1 kg разтворител, См- моларна концентрация на разтвора.
Ебулиоскопия- метод за изследване на течни разтвори на нелетливи вещества, базиран на измерване на повишаването на точката на кипене на разтвор в сравнение с точката на кипене на чист разтворител. Покачване на точката на кипене (Δtbp) на разтвора: Δt бала = i E C m, където E е ебулиоскопската константа (константа) на разтворителя - големината на повишаването на точката на кипене на разтвор, който съдържа 1 мол разтворено вещество на 1 kg разтворител. Изотоничен коефициент ( аз) е свързано със степента на дисоциация ( α ) електролитно съотношение α =[(i - 1) / (k - 1)] , където k - броят на йоните, на които се разлага електролитната молекула при дисоциация (за KCl k=2,за BaC1 2 и Na 2 SO 4 k = 3 и т.н.).
Тестови въпроси:
1. От какви компоненти се състои разтворът?
2. Какви разтвори се наричат наситени?
3. Избройте основните начини за изразяване на концентрацията на разтворите.
4. Какво означават записите: 2,5 M NaOH, 0,1 n H 2 SO 4?
1. Глинка Н.Л. Обща химия: учебник. надбавка за университети / N.L. Глинка. - М.: КНОРУС, 2009. - С. 217 - 236.
2. Коровин Н.В. Обща химия: учебник за технически направления. и специални университети - 7 изд., попр. - М.: Висше училище, 2006. - С. 204.
Е.А. Буйлова, Д.Р. Галиева
Край на работата -
Тази тема принадлежи на:
Студентска библиотека на USPTU
състояние образователна институцияпо-висок професионално образование... Уфимски държавен петролен технологичен университет... Студентска библиотека UGNTU КРАТЪК ЛЕКЦИОНЕН КУРС за студенти...
Ако се нуждаеш допълнителен материалпо тази тема или не сте намерили това, което търсите, препоръчваме да използвате търсенето в нашата база данни с произведения:
Какво ще правим с получения материал:
Ако този материал се оказа полезен за вас, можете да го запазите на страницата си в социалните мрежи:
| туит |
Всички теми в този раздел:
КРАТЪК КУРС ЛЕКЦИИ
ПО ДИСЦИПЛИНАТА "ХИМИЯ" за студенти от нехимични специалности общо изданиеПрофесор С.С. Злоцки и проф.
За студенти от нехимични специалности: PG, BPG, PS, BPS, VV, DS, ES, GF
Модул 1 "Реактивност на веществата". Лекции – 8 часа, работилници- 4 часа домашна работа No1 Номер на тема Въпроси
Лекция 1. Квантово-механичен модел на структурата на атома
Ключови думи: атом, корпускулярно-вълнови свойства на атомите, принцип на неопределеност, квантови числа, орбитала, нива и поднива на орбиталите. Атом - чи
Лекция 2. Електронни конфигурации на атоми. Периодичен закон. Периодична система на D.I. Менделеев
Ключови думи: електронна структура на атомите, последователност от енергийни нива и поднива на атоми, принципи на запълване на атомни орбитали с електрони, периодичен ред
Лекция 3. Основните видове химични връзки. ковалентна връзка
Ключови думи: видове химични връзки: йонни, метални, ковалентни, σ - и - връзки, свойства на ковалентната връзка, механизми на образуване на връзката, валентност.
Полярност и поляризуемост на ковалентна връзка и молекули
Ключови думи: насоченост на ковалентна връзка, геометрия на молекулите, хибридизация, хибридни орбитали, полярност, поляризуемост, диполен електрически момент.
Лекция 5. Междумолекулни взаимодействия. водородна връзка
Ключови думи: междумолекулно взаимодействие, видове взаимодействия, механизми на взаимодействие, водородна връзка. електрически неутрален
Лекция 6. Химична термодинамика
Ключови думи: първи и втори закон на термодинамиката, стандартна топлина на образуване на материята, енталпия, закон на Хес и неговите последствия, ентропия, енергия на Гибс, посока на чи
Лекция 7. Химична кинетика
Ключови думи: скорост на химичните реакции, закон на масовото действие, правило на Вант Хоф, уравнение на Арениус, енергия на активиране, хомогенна и хетерогенна катализа.
Лекция 8. Химично равновесие
Ключови думи: обратими и необратими химични реакции, химично равновесие в хомо- и хетерогенни системи, равновесна константа, изместване на химичното равновесие
Лекция 10. Дисперсни системи. Повърхностни явления
Ключови думи: дисперсна среда, дисперсна фаза, адсорбция, ПАВ. Дисперсните системи са разнородни системи, състоящи се от
Видове хетерогенни дисперсни системи
(класификация по агрегатни състояния) Агрегатно състояние на дисперсионната среда Агрегатно състояние на дисперсната фаза газообразен
Дисоциация
Ключови думи: електролити, солватация, степен на дисоциация, константа на дисоциация, йонна силаразтвор, йонна активност, коефициент на активност, закон на разреждане
Индикатор за водород
Ключови думи: йонен продукт на вода, водороден показател (pH), хидроксилен индекс (pOH), киселина, основа, изчисляване на pH в киселинни и основни разтвори.
Изчисляване на pH в разтвори на силни и слаби киселини
1. Тъй като дисоциацията на силна киселина (HNO3, HCl, H2SO4, HI, HBr, HClO4) протича почти напълно, можем да приемем: = киселина
Изчисляване на pH в разтвори на силни и слаби основи
1. Дисоциацията на силна основа (LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ca(OH)2, Sr(OH)2, Ba(OH)2) протича почти напълно: NaOH Na+ + OH
Лекция 13. Продукт на разтворимост. Йонообменни реакции
Ключови думи: трудноразтворими силни електролити, продукт на разтворимост, разтворимост, йонообменни реакции, реакция на неутрализация. Наситени па
Лекция 14. Хидролиза на соли. буферни разтвори
Ключови думи: хидролиза, катионна хидролиза, анионна хидролиза, катионна и анионна хидролиза, константа на хидролиза (Kg), степен на хидролиза (h), pH на солни разтвори, буферни разтвори,
Лекция 15
Ключови думи: редокс реакции (ORR), степен на окисление, окислител, редуктор, окисляване, редукция, метод на електронен баланс, йонно-електронен метод
Лекция 16. Концепцията за "електроден потенциал". Електрохимични процеси
Ключови думи: електроден потенциал, галваничен елемент, електрохимични вериги, стандартен водороден електрод, стандартен електроден потенциал от метал, серия
Лекция 17
Ключови думи: електролиза на стопилки и солеви разтвори, катод, инертен и активен анод, потенциал на разлагане. Електролиза -
Лекция 18
Ключови думи: метална връзка, електронен газ, серия от активност на метали, активни метали, метали с междинна активност, благородни метали, огнеупорни метали, "амфотерни"
Химични свойства на металите
Основната характеристика на металите като химикали е способността им да губят електрони при взаимодействие с други атоми, показвайки редуциращи свойства. Според редуктора
Лекция 19. Корозия на метали. Методи за защита от корозия
Ключови думи: електрохимична и химична корозия на метали, методи за защита от корозия. Корозия - спонтанно окисление-редукция
Приложение на устойчиви на корозия материали.
3. Третиране на корозивна среда с реагенти.Инхибиторите действат като реагенти, които забавят корозията. В зависимост от естеството на метала и околната среда, различни и
Лекция 20. Метали от главната подгрупа на II група. Твърдостта на водата
Ключови думи: физични и химични свойства на металите, оксиди, хидроксиди, соли на металите от IIA група. Твърдост на водата, премахване на твърдостта. Начало под
Лекция 21. Конструкционни метали. Алуминий. хром. Желязо
Ключови думи: физични и химични свойства на метали, оксиди, хидроксиди, метални соли. Алуминият е основният представител на металите от основна подгрупа I
Лекция 22
Ключови думи: полимер, мономер, полимеризация, поликондензация, пластмаси, еластомери, каучуци, каучуци. Нар. високомолекулни съединения (НМС) или полимери
Лекция 23
Ключови думи: химична идентификация, качествен и количествен анализ, аналитичен сигнал, аналитична реакция, групов реагент, специфични реагенти
Допълнителен
2.1. Ахметов Н.С. Обща и неорганична химия: учебник за ВУЗ - 4 изд. правилно - М: Висше училище, 2002. - 743 с. 2.2. Карапетянц М.Х., Дракин С.И. Обща и неорганична химия: учебници